E o nosso 1º Período chegou ao fim.
Quero desejar a todos um FELIZ NATAL e um BOM ANO NOVO.
Espero-vos no próximo Período.
Olá, eu sou a Maria e este é o meu blog da disciplina de CFQ. Espero que este blog ajude a aprender ou a compreender melhor a matéria. Bom... VAMOS COMEÇAR!!!
sábado, 14 de dezembro de 2013
Ligação Covalente
Quando a ligação entre átomos das moléculas consiste na compartilha de eletrões, chama-se ligação covalente.
A ligação diz-se:
A ligação diz-se:
- SIMPLES - quando há compartilha de um par de eletrões por 2 átomos
- DUPLA - quando há compartilha de 2 pares de eletrões por 2 átomos
- TRIPLA - quando há compartilha de 3 pares de eletrões por 2 átomos
Estas ligações podem facilmente ser representadas:
- Pela Notação de Lewis (onde se identifica o elemento rodeado pelos eletrões de valência, representados por pontos ou cruzes;
- Pela fórmula de estrutura, onde cada 2 eletrões são representados por 1 traço.
Chama-se ângulo de ligação ao ângulo formado pelos segmentos de reta que unem o núcleo de um do átomo aos núcleos de dois átomos a ele ligados.
A geometria das moléculas resulta da distribuição dos seus átomos no espaço.
A geometria de moléculas pequenas pode ser:
Ligação Química
A NUVEM ELETRÓNICA DAS MOLÉCULAS
Se fosse possível fotografar os eletrões de uma molécula muitas vezes seguidas, obter-se-ia uma espécie de nuvem em torno dos núcleos dos átomos. Essa nuvem não é distribuída uniformemente: é mais densa nas zonas próximas do núcleo e entre os núcleos dos átomos ligados, e menos densa nas zonas afastadas dos núcleos, onde é menos provável encontrar os eletrões.
Molécula Elementar ou Simples - átomos do mesmo elemento químico
Molécula Composta - átomos de diferentes elementos químicos
MOLÉCULA DE DIHIDROGÉNIO ,H2
A molécula de hidrogénio é constituída por dois átomos do elemento hidrogénio ligados quimicamente entre si. A nuvem eletrónica da molécula é mais densa nas zonas próximas de cada um dos núcleos e entre eles.
A distância média entre os núcleos dos dois átomos chama-se comprimento da ligação hidrogénio-hidrogénio e o seu valor é de 74 pm.
MOLÉCULA DE CLORETO DE HIDROGÉNIO, HCl
A molécula de cloreto de hidrogénio é formada por um átomo de cloro ligado quimicamente a um átomo de hidrogénio.
O comprimento de ligação hidrogénio-cloro é de 127 pm.
O Tamanho das moléculas depende do tamanho dos átomos que as constituem. Quanto maior são os átomos, maiores são as moléculas.
Nas moléculas formadas por dois átomos diferentes como HCl, a densidade da nuvem eletrónica é maior perto de um dos átomos. Por isso, junto desse átomo há excesso de carga negativa que fica a faltar junto de outro átomo. Existem então dois pólos nestas moléculas:
Nas moléculas formadas por dois átomos iguais, como H2 e Cl2, a densidade da nuvem eletrónica é igual junto de cada um dos átomos, por isso não há polos. Diz-se que as moléculas são apolares.
Eletrões de Valência – responsáveis pelas ligações químicas
De modo a destacar a importância desses eletrões e como ocorre a ligação química, utiliza-se a notação de Lewis:
Se fosse possível fotografar os eletrões de uma molécula muitas vezes seguidas, obter-se-ia uma espécie de nuvem em torno dos núcleos dos átomos. Essa nuvem não é distribuída uniformemente: é mais densa nas zonas próximas do núcleo e entre os núcleos dos átomos ligados, e menos densa nas zonas afastadas dos núcleos, onde é menos provável encontrar os eletrões.
Molécula Elementar ou Simples - átomos do mesmo elemento químico
Molécula Composta - átomos de diferentes elementos químicos
MOLÉCULA DE DIHIDROGÉNIO ,H2
A molécula de hidrogénio é constituída por dois átomos do elemento hidrogénio ligados quimicamente entre si. A nuvem eletrónica da molécula é mais densa nas zonas próximas de cada um dos núcleos e entre eles.
A distância média entre os núcleos dos dois átomos chama-se comprimento da ligação hidrogénio-hidrogénio e o seu valor é de 74 pm.
MOLÉCULA DE CLORETO DE HIDROGÉNIO, HCl
A molécula de cloreto de hidrogénio é formada por um átomo de cloro ligado quimicamente a um átomo de hidrogénio.
O comprimento de ligação hidrogénio-cloro é de 127 pm.
O Tamanho das moléculas depende do tamanho dos átomos que as constituem. Quanto maior são os átomos, maiores são as moléculas.
Nas moléculas formadas por dois átomos diferentes como HCl, a densidade da nuvem eletrónica é maior perto de um dos átomos. Por isso, junto desse átomo há excesso de carga negativa que fica a faltar junto de outro átomo. Existem então dois pólos nestas moléculas:
- O pólo negativo, onde há excesso de carga negativa;
- O pólo positivo, onde há falta de carga negativa.
Nas moléculas formadas por dois átomos iguais, como H2 e Cl2, a densidade da nuvem eletrónica é igual junto de cada um dos átomos, por isso não há polos. Diz-se que as moléculas são apolares.
Eletrões de Valência – responsáveis pelas ligações químicas
De modo a destacar a importância desses eletrões e como ocorre a ligação química, utiliza-se a notação de Lewis:
- Símbolo Químico (que aqui representa o núcleo e os eletrões internos de um átomo);
- Representa-se os eletrões de valência por cruzes ou pontos à volta do símbolo.
domingo, 24 de novembro de 2013
Estudo de um elemento químico
Vou fazer um estudo sobre um dos elementos químicos da Tabela Periódica. Eu escolhi... Potássio (K)
POTÁSSIO (K)
O potássio é um elemento químico do grupo 1 ( metais alcalinos) e pertence ao quarto período. A sua massa atómica é 19 e tem uma cor branco prateado. É um elemento muito reativo ( especialmente com a água) e oxida muito rapidamente.
Os principais sais naturais de potássio são a silvite (cloreto de potássio KCl), a carnalite (cloreto duplo de potássio e magnésio KClMgCl2.6H2O), acainite (clorossulfato de magnésio e potássio KClMgSO4.3H2O), a langbeinite (sulfato duplo de potássio e magnésio K2SO4. MgSO4. 6H2O), asilvinite (mistura de silvite e cloreto de sódio) e o nitro ou salitre (nitrato de potássio KNO3).
As maiores jazidas de sais de potássio encontram-se nos EUA, Alemanha, Federação Russa, Canadá, França e Espanha. Estas jazidas surgiram porevaporação de antigos mares.
O potássio obtém-se por eletrólise do hidróxido de potássio fundido.
Este elemento, quimicamente muito ativo, reage com a água, formando o hidróxido de potássio, com inflamação do hidrogénio que se liberta.
Os compostos mais importantes de potássio são o cloreto de potássio (KCl); o sulfato de potássio (K2SO4), que se encontra na Natureza na formade sais; o nitrato de potássio (KNO3); o carbonato de potássio (K2CO3) e o hidróxido de potássio (KOH), que se pode obter por eletrólise de umasolução de cloreto de potássio e que se utiliza no fabrico de sabões.
O potássio tem diversas aplicações técnicas, nomeadamente nas células fotoelétricas alcalinas usadas no cinema e na televisão, para transformara luz em corrente elétrica.
POTÁSSIO (K)
O potássio é um elemento químico do grupo 1 ( metais alcalinos) e pertence ao quarto período. A sua massa atómica é 19 e tem uma cor branco prateado. É um elemento muito reativo ( especialmente com a água) e oxida muito rapidamente.
O Potássio tem um raio atómico maior do que o hélio e é o segundo metal mais leve. É maleável e dá para cortar com uma faca.
Foi descoberto por Humphry Davy em 1807.
O nome potássio deriva do latim kalium e do inglês potash.
Na Natureza, tal como o sódio, o potássio apresenta-se maioritariamente sob a forma de cloreto. Encontra-se também, sob a forma defeldspatos, como a ortóclase (K(AlSi3O8)), silicato de alumínio e potássio e de sais potássicos, que são indispensáveis ao crescimento das plantas.Os principais sais naturais de potássio são a silvite (cloreto de potássio KCl), a carnalite (cloreto duplo de potássio e magnésio KClMgCl2.6H2O), acainite (clorossulfato de magnésio e potássio KClMgSO4.3H2O), a langbeinite (sulfato duplo de potássio e magnésio K2SO4. MgSO4. 6H2O), asilvinite (mistura de silvite e cloreto de sódio) e o nitro ou salitre (nitrato de potássio KNO3).
As maiores jazidas de sais de potássio encontram-se nos EUA, Alemanha, Federação Russa, Canadá, França e Espanha. Estas jazidas surgiram porevaporação de antigos mares.
O potássio obtém-se por eletrólise do hidróxido de potássio fundido.
Este elemento, quimicamente muito ativo, reage com a água, formando o hidróxido de potássio, com inflamação do hidrogénio que se liberta.
Os compostos mais importantes de potássio são o cloreto de potássio (KCl); o sulfato de potássio (K2SO4), que se encontra na Natureza na formade sais; o nitrato de potássio (KNO3); o carbonato de potássio (K2CO3) e o hidróxido de potássio (KOH), que se pode obter por eletrólise de umasolução de cloreto de potássio e que se utiliza no fabrico de sabões.
O potássio tem diversas aplicações técnicas, nomeadamente nas células fotoelétricas alcalinas usadas no cinema e na televisão, para transformara luz em corrente elétrica.
Tabela Periódica dos Elementos
Todos os elementos estão dispostos na Tabela Periódica por ordem crescente do seu número atómico.
Nesta tabela, os elementos formam:
Nesta tabela, os elementos formam:
- colunas verticais, os grupos.
- linhas horizontais, os períodos.
Há 18 grupos, na Tabela Periódica, numerados de 1 a 18. Os grupos são constituídos por elementos com propriedades químicas semelhantes os quais formam famílias de elementos.
Há 7 períodos na Tabela Periódica.
Os átomos de cada elemento
Número atómico e número de massa
Os átomos de um elemento e os correspondentes iões têm o mesmo número de protões.
Ao número de protões existentes no núcleo dos átomos e dos iões de um elemento chama-se número atómico; representa-se pela letra Z e caracteriza o elemento químico.
Todos os átomos e iões do mesmo elemento têm igual número atómico.
Exemplificando:
Os átomos de um elemento e os correspondentes iões têm o mesmo número de protões.
Ao número de protões existentes no núcleo dos átomos e dos iões de um elemento chama-se número atómico; representa-se pela letra Z e caracteriza o elemento químico.
Todos os átomos e iões do mesmo elemento têm igual número atómico.
Exemplificando:
- todos os átomos de magnésio e todos os iões magnésio têm 12 protões no seu núcleo; o número atómico 12 é característico do elemento magnésio.
Ao número total de partículas existentes no núcleo dos átomos e iões monoatómicos, soma dos protões e neutrões, chama-se número de massa. Representa-se pela letra A. É importante notar que o número de massa não é uma massa. O número de massa é um número inteiro, sem unidades, igual ao total de partículas do núcleo.
Podemos representar qualquer átomo associando ao símbolo químico do elemento o seu número atómico e o seu número de massa:
onde: A = Z + N
Isótopos de um elemento
Todos os átomos de um elemento têm o mesmo número atómico, isto é, têm igual número de protões. No entanto, podem não ser todos iguais. Há átomos do mesmo elemento com diferente número de neutrões e, por isso, com número de massa diferente.
Os átomos diferentes do mesmo elemento chamam-se isótopos.
Os isótopos de um elemento têm:
- o mesmo número atómico Z;
- diferente número de massa A, pois o número de neutrões N é diferente.
Elemento Hidrogénio
Todos os átomos de hidrogénio têm 1 protão e, também, 1 eletrão, pois o número atómico do hidrogénio é Z = 1.
Mas há 3 tipos de átomos de hidrogénio: a diferença está no número de neutrões existentes no núcleo.
Os três isótopos têm as mesmas propriedades químicas porque as nuvens electrónicas são iguais.
O tamanhos dos Átomos
Os átomos são muito pequenos, por isso não os vemos!....
No entanto, há técnicas modernas que nos fornecem imagens dos átomos, tornando possível determinar o seu tamanho. Por exemplo, através do microscópio electrónico de alta resolução.
Embora muito pequenos e sem forma definida, os átomos não têm todos o mesmo tamanho. Se considerarmos que têm a forma esférica, podemos comparar os tamanhos de diferentes átomos através dos valores dos seus diâmetros.
Os valores dos diâmetros atómicos exprimem-se habitualmente num submúltiplo do metro - o picómetro , símbolo pm:
1 pm = 0,000 000 000 001 m
domingo, 3 de novembro de 2013
Constituição Atómica
Um átomo é constituído por uma nuvem atómica e uma nuvem eletrónica.
A nuvem atómica é constituída por:
A nuvem eletrónica é constituída por:
A nuvem atómica é constituída por:
- Protões - partícula com carga elétrica positiva;
- Neutrões - partícula sem carga elétrica (carga nula).
A nuvem eletrónica é constituída por:
- Eletrões - partícula com carga elétrica negativa.
Modelos Atómicos
Ao longo dos tempos, foram aparecendo diferentes modelos para explicar a forma e a constituição de um átomo.
MODELO ATÓMICO DE DALTON
Dalton, admitiu que a matéria era constituída por pequenas esferas maciças invisíveis - os átomos.
MODELO ATÓMICO DE THOMSON
Neste modelo, o átomo é constituído por uma esfera de carga elétrica positiva, na qual estão imersos os eletrões com carga elétrica negativa.
MODELO ATÓMICO DE RUTHERFORD
Neste modelo, o átomo é constituído por um núcleo, portador de carga elétrica positiva, à volta do qual rodam os eletrões, descrevendo órbitas elípticas.
MODELO ATÓMICO DE BOHR
O átomo é constituído por um núcleo, tal como no modelo de Rutherford, mas em que os eletrões se movem em orbitas circulares em torno do núcleo, correspondendo a cada uma delas um nível de energia. Os eletrões podem passar de uma órbita para outra por absorção.
MODELO DA NUVEM ELETRÓNICA (modelo atual)
Este é o modelo mais atual e correto da constituição do átomo, feito com base nos conhecimentos que temos hoje em dia.
Segundo este modelo, a zona central do átomo (núcleo) é constituída por protões (partículas com carga positiva) e neutrões (partículas com carga neutra); à volta do núcleo giram os eletrões (partículas com carga negativa) em órbitas não definidas, ou seja, possuem movimentos aleatórios; a maior parte dos eletrões encontram-se mais próximos do núcleo mas também há alguns mais afastados; o núcleo é muito pequeno comparado com o tamanho da nuvem eletrónica, ou seja, a maior parte do átomo é espaço vazio.
MODELO ATÓMICO DE DALTON
Dalton, admitiu que a matéria era constituída por pequenas esferas maciças invisíveis - os átomos.
MODELO ATÓMICO DE THOMSON
Neste modelo, o átomo é constituído por uma esfera de carga elétrica positiva, na qual estão imersos os eletrões com carga elétrica negativa.
MODELO ATÓMICO DE RUTHERFORD
Neste modelo, o átomo é constituído por um núcleo, portador de carga elétrica positiva, à volta do qual rodam os eletrões, descrevendo órbitas elípticas.
MODELO ATÓMICO DE BOHR
O átomo é constituído por um núcleo, tal como no modelo de Rutherford, mas em que os eletrões se movem em orbitas circulares em torno do núcleo, correspondendo a cada uma delas um nível de energia. Os eletrões podem passar de uma órbita para outra por absorção.
MODELO DA NUVEM ELETRÓNICA (modelo atual)
Este é o modelo mais atual e correto da constituição do átomo, feito com base nos conhecimentos que temos hoje em dia.
Segundo este modelo, a zona central do átomo (núcleo) é constituída por protões (partículas com carga positiva) e neutrões (partículas com carga neutra); à volta do núcleo giram os eletrões (partículas com carga negativa) em órbitas não definidas, ou seja, possuem movimentos aleatórios; a maior parte dos eletrões encontram-se mais próximos do núcleo mas também há alguns mais afastados; o núcleo é muito pequeno comparado com o tamanho da nuvem eletrónica, ou seja, a maior parte do átomo é espaço vazio.
9º ANO
OLÁ
Bem vindos ao 9ºano. Este é o último ano do ensino básico e temos de nos aplicar assério. Neste primeiro período iremos falar da Estrutura Atómica, das Propriedades dos Elementos, da Tabela Periódica dos Elementos Químicos e da ligação Química.
BOM, VAMOS COMEÇAR...
domingo, 9 de junho de 2013
Curiosidade..... O que é um Sonar?
Um Sonar é um dispositivo utilizado em algumas embarcações, que emite ondas sonoras debaixo de água, para detectar e localizar a posição de objetos submersos. É posível com o sonar, fazer um mapa do fundo do mar, localizar cardumes, navios, submarinos ou mergulhadores perdidos.
Considerando que na água a visão é limitada, o sonar é um dispositivo de grande utilidade. Quando se percebeu que não era possível aumentar a visibilidade na água usando apenas a luz, os engenheiros começaram a utilizar o som, já que a sua velocidade aumenta sensivelmente quando vai para a água, percorrendo uma distância bem maior que a luz. As ondas sonoras utilizadas no sonar são chamadas de ultra-sons, pois tem uma frequência acima de 20.000 Hz, logo os seres humanos não as conseguem ouvir.

O Arco-íris
Quando a luz branca do Sol incide numa gota de água, refrata-se (pois há mudança de meio ótico) e muda de direção no seu interior.
A luz branca do Sol é constituída por várias radiações, todas com características diferentes, pelo que dentro da gota de água cada radiação vai propagar-se a uma velocidade diferente (dispersão), sofrer uma reflexão e nova refração (quando sai da gota de água).

A luz branca do Sol é constituída por várias radiações, todas com características diferentes, pelo que dentro da gota de água cada radiação vai propagar-se a uma velocidade diferente (dispersão), sofrer uma reflexão e nova refração (quando sai da gota de água).

A Cor e a Luz
A cor é um fenómeno ótico que se verifica quando sobre um mesmo objeto incide luz e varia com o tipo de radiação que sobre ele incide.
Um corpo absorve, reflete e transmite determinadas radiações, de entre aquelas que recebe. Assim, a cor que um corpo apresenta depende do tipo de radiação que sobre ele incide e da sua natureza.
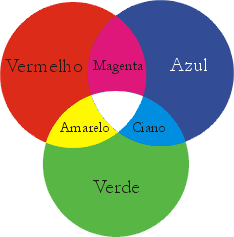
 Pode obter-se luz de qualquer cor a partir da sobreposição das três cores primárias da luz - vermelho verde e azul. A sobreposição destas três cores, com igual intensidade, origina luz branca. A sobreposição de duas cores primárias da luz origina uma cor secundária:
Pode obter-se luz de qualquer cor a partir da sobreposição das três cores primárias da luz - vermelho verde e azul. A sobreposição destas três cores, com igual intensidade, origina luz branca. A sobreposição de duas cores primárias da luz origina uma cor secundária:
Um corpo absorve, reflete e transmite determinadas radiações, de entre aquelas que recebe. Assim, a cor que um corpo apresenta depende do tipo de radiação que sobre ele incide e da sua natureza.

vermelho + verde = amarelo
vermelho + azul = magenta
verde + azul = ciano
Uma cor secundária e a primária que não lhe deu origem são cores complementares; por exemplo, o amarelo e o azul são cores suplementares.
sábado, 8 de junho de 2013
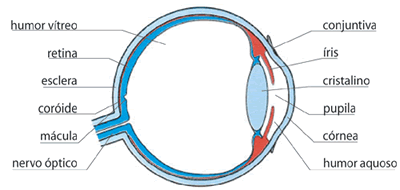
Constituição do olho
O olho encontra-se alojado numa cavidade óssea - órbita. Possui uma forma aproximadamente esférica, cujo interior se encontra cheio de dois tipos de fluidos: humor aquoso e humor vítreo.

Refração da Luz
A Refração da Luz é um fenómeno que ocorre quando a luz passa de um meio para outro, onde a velocidade de propagação é diferente. Quando a luz é refratada, sofre mudança de direção, excepto se a incidência for perpendicular à superfície de separação dos meios.
 O ângulo crítico ou ângulo limite é o ângulo de incidência para o qual o ângulo de refração é de 90º.
O ângulo crítico ou ângulo limite é o ângulo de incidência para o qual o ângulo de refração é de 90º.
A reflexão Total é um fenómeno que ocorre quando a luz incide, com um ângulo superior ao ângulo crítico, na superfície de separação de dois meios, sendo a velocidade de propagação da luz menor no meio onde a luz está a propagar-se.

A reflexão Total é um fenómeno que ocorre quando a luz incide, com um ângulo superior ao ângulo crítico, na superfície de separação de dois meios, sendo a velocidade de propagação da luz menor no meio onde a luz está a propagar-se.
Os Espelhos
Espelhos Planos
Os espelhos planos são superfícies polidas que reflectem regularmente a luz e permitem obter imagens nítidas dos objectos.
As imagens reflectidas pelo espelho tem as seguintes características:
Os espelhos planos são superfícies polidas que reflectem regularmente a luz e permitem obter imagens nítidas dos objectos.
As imagens reflectidas pelo espelho tem as seguintes características:
- são direitas e do mesmo tamanho que o objecto;
- estão à mesma distância do espelho que o objecto;
- são virtuais, pois não se conseguem projectar num alvo;
- são lateralmente invertidas, a parte esquerda da imagem corresponde à parte direita do objecto.
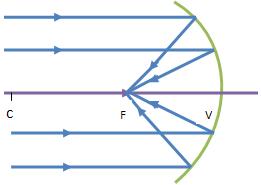
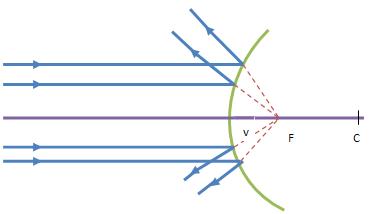
Espelhos Côncavos
Nos espelhos côncavos, os raios incidentes paralelos ao eixo principal, quando são refletidos convergem para um ponto, que se designa foco principal do espelho.
Este foco é real, porque pode ser projetado num alvo. Forma-se na interseção dos raios refletidos, à frente do espelho.

Espelhos Convexos
Nos espelhos convexos, os raios incidentes paralelos ao eixo principal, quando são refletidos, divergem. Os prolongamentos dos raios refletidos encontram-se num ponto, o foco principal do espelho.
Este foco é virtual, porque não pode ser projetado, formando-se no prolongamento dos raios refletidos, para trás do espelho.

Reflexão da Luz
A reflexão da luz é a mudança de direcção ou de sentido que ocorre quando os raios luminosos incidem em certas superfícies, continuando a luz a propagar-se no mesmo meio óptico.
Os ângulos de incidência e de reflexão são iguais (têm a mesma amplitude).

- Reflexão regular – reflexão nas superfícies polidas.
- Reflexão difusa – quando os raios incidem numa superfície rugosa e mudam de duração de forma irregular.
Os ângulos de incidência e de reflexão são iguais (têm a mesma amplitude).

Quando o raio incide perpendicularmente à superfície (ângulo de incidência de 0ºC), o raio refletido tem a mesma direção do raio incidente, havendo apenas mudança de sentido.
Triângulo de Visão
Para ver um objeto, é necessária a existência de três aspetos fundamentais, que constituem o triângulo de visão: o objeto, uma fonte luminosa que ilumine o objeto e um detetor de luz (por exemplo, os olhos de uma pessoa).


A Luz
A luz tal como o som é um fenómeno de natureza ondulatória. A luz é uma radiação eletromagnética, que se propaga através de diferentes meios materiais, como o ar ou a água e também se propaga através do vazio. Existem alguns tipos de sólidos (chamados de opacos) que não se deixam atravessar pela luz.
A Luz propaga-se em linha reta e redialmente em todas as direções num meio isotrópico.
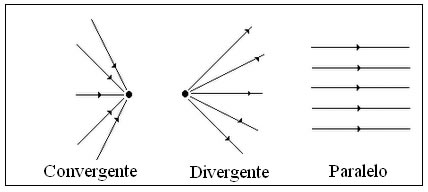
Cada uma das direções retilíneas segundo a qual se propaga a luz chama-se raio luminoso. Ao conjunto de raios luminosos chamamos feixe de raios luminosos. Quanto ao seu modo de propagação, os feixes luminosos podem ser paralelos, convergentes ou divergentes.
 Todos os corpos que possuem luz própria são corpos luminosos, enquanto que os corpos que apenas reflectem a luz são corpos iluminados.
Todos os corpos que possuem luz própria são corpos luminosos, enquanto que os corpos que apenas reflectem a luz são corpos iluminados.
A Luz propaga-se em linha reta e redialmente em todas as direções num meio isotrópico.
Cada uma das direções retilíneas segundo a qual se propaga a luz chama-se raio luminoso. Ao conjunto de raios luminosos chamamos feixe de raios luminosos. Quanto ao seu modo de propagação, os feixes luminosos podem ser paralelos, convergentes ou divergentes.

Sem a luz emitida pelo Sol (que é a nossa principal fonte de luz) ou por outro corpo luminoso, os nossos olhos não conseguiriam ver os objetos que não têm luz própria (os corpos iluminados).
 |
| Exemplo de um corpo luminoso: O Sol |
O Ouvido Humano
O ouvido Humano é constituído por ouvido externo, ouvido médio e ouvido interno.
As vibrações sonoras são captadas pelo ouvido externo (no tímpano) e transmitidas ao ouvido médio, que as amplifica e envia ao ouvido interno.

As vibrações sonoras são captadas pelo ouvido externo (no tímpano) e transmitidas ao ouvido médio, que as amplifica e envia ao ouvido interno.

Eco e Reverberação
O Eco resulta da reflexão do som quando este encontra superfícies duras e lisas.
A reflexão é um fenómeno ondulatório que ocorre quando a onda é obrigada a mudar de direção, ao encontrar um obstáculo.
Para distinguir claramente o som refletido do som original, é necessário que exista entre eles um intervalo mínimo de 0,1 s.
No ar o som propaga-se com uma velocidade de 340 m/s.
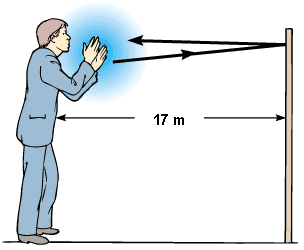
Quando, num local, existem vários obstáculos a distâncias superiores a 17 m, o mesmo som pode repetir-se várias vezes, ocorrendo vários ecos - ecos múltiplos.
Quando a distância entre a fonte sonora e a superfície refletora é inferior a 17 m, ocorre a reverberação do som.
Ondas
Uma onda é uma perturbação que se inicia num ponto e se propaga, transferindo energia de um ponto para o outro.
Existem ondas sísmicas, ondas do mar, ondas sonoras, ondas lumisosas,etc.
Todas as ondas se propagam transferindo energia de um ponto para o outro.
Ondas Mecânicas
As ondas Mecânicas, para se propagarem, necessitam de um meio material. As ondas sonoras resultam da vibração das partículas do meio onde se propagam logo, as ondas sonoras, tal como as ondas sísmicas ou as ondas do mar, são ondas mecânicas.
Ondas Eletromagnéticas
As ondas eletromagnéticas não necessitam de um meio material para se propagar, propagam-se no vazio.
Ondas Longitudinais e Transversais
As ondas Longitudinais são aquelas em que a direção da propagação coincide com a direção da vibração.
Nas ondas Transversais, a direção da propagação e da vibração são perpendiculares.
Ondas Periódicas
Numa onda periódica, todas as partículas do meio vibram de igual forma.
As grandezas físicas que constituem uma onda Periódica são: o comprimento de onda, a amplitude, a frequência e o período.
O comprimento de onda (λ) é a distância mínima entre dois pontos que estão na mesma fase (unidade de base do SI: metro). A amplitude (A) numa onda mecânica corresponde ao valor máximo da elongação. A frequência (ƒ) é o número de ciclos realizados por unidade de tempo (segundos) (unidade de base do SI: Hertz). O período (Т) é o intervalo de tempo mínimo em que se completa um ciclo e expressa-se em segundos.
A frequência e o período são grandezas inversamente proporcionais.
Existem ondas sísmicas, ondas do mar, ondas sonoras, ondas lumisosas,etc.
Todas as ondas se propagam transferindo energia de um ponto para o outro.
Ondas Mecânicas
As ondas Mecânicas, para se propagarem, necessitam de um meio material. As ondas sonoras resultam da vibração das partículas do meio onde se propagam logo, as ondas sonoras, tal como as ondas sísmicas ou as ondas do mar, são ondas mecânicas.
Ondas Eletromagnéticas
As ondas eletromagnéticas não necessitam de um meio material para se propagar, propagam-se no vazio.
Ondas Longitudinais e Transversais
As ondas Longitudinais são aquelas em que a direção da propagação coincide com a direção da vibração.
Nas ondas Transversais, a direção da propagação e da vibração são perpendiculares.
Numa onda periódica, todas as partículas do meio vibram de igual forma.
As grandezas físicas que constituem uma onda Periódica são: o comprimento de onda, a amplitude, a frequência e o período.
O comprimento de onda (λ) é a distância mínima entre dois pontos que estão na mesma fase (unidade de base do SI: metro). A amplitude (A) numa onda mecânica corresponde ao valor máximo da elongação. A frequência (ƒ) é o número de ciclos realizados por unidade de tempo (segundos) (unidade de base do SI: Hertz). O período (Т) é o intervalo de tempo mínimo em que se completa um ciclo e expressa-se em segundos.
A frequência e o período são grandezas inversamente proporcionais.
O Som
Os sons que conseguimos distinguir no nosso dia a dia podem ser muito diferentes uns dos outros. Conseguimos distinguir sons tão distintos como os sons musicais provenientes de diversos instrumentos, a fala ou o canto, e um conjunto diversificado de ruídos como as explosões, o bater do martelo, o ranger de uma porta ou até uma pedra caindo dentro de água.
Com os nossos orgãos da fala, tanto podemos produzir sons, como ruídos, e à medida que vamos crescendo, vamos aprendendo a controlar melhor a nossa capacidade de produzir sons e ruídos. Para isso recorremos às cordas vocais, que vibram e transmitem essa vibração ao ar. Com a nossa boca conseguimos controlar a saída do ar e assim enriquecer a diversidade de sons que podemos articular.
Normalmente os sons produzidos pelos homens têm uma frequência menor do que os sons produzidos pelas mulheres (são sons mais graves), isto porque as cordas vocais dos homens são maiores do que as das mulheres.
Como se propaga o Som?
O som necessita de um meio material, sólido, líquido ou gasoso, para se propagar (para chegar de um lado a outro). A velocidade de propagação do som depende desse meio. Normalmente a velocidade de propagação das ondas sonoras é maior nos sólidos e menor nos gases. Esta velocidade também depende da temperatura a que o meio de propagação se encontra.
A velocidade média de propagação do som no ar é de 340 m/s . Isto que dizer que em cada segundo, o som percorre 340 metros de distância.
Não há propagação de som no vazio (no espaço, por exemplo), devido à ausência de partículas.
O som é recebido pelo receptor sonoro que no nosso caso, são os ouvidos.
A História do Som
As primeiras investigações sobre o som foram iniciadas na Antiguidade, com o trabalho de filósofos gregos como Pitágoras, no século VI a.C. e continuados ao longo dos séculos, realçando-se os trabalhos de Galileu.
Galileu iniciou o estabelecimento das relações numéricas entre o som em função das vibrações do objeto sonoro. Verificou-se que um determinado número de vibrações por segundo dá como resultado um som específico. Aumentar a frequência do número de vibrações por segundo torna o som mais agudo, enquanto a operação inversa produz um som mais grave.
Joseph Sauver, considerado o pai da acústica musical, descobriu o número exato de vibrações em cada som para o ouvido humano o captar. Estabeleceu-se entre 30.000 e 40.000 vibrações por segundo.
Galileu iniciou o estabelecimento das relações numéricas entre o som em função das vibrações do objeto sonoro. Verificou-se que um determinado número de vibrações por segundo dá como resultado um som específico. Aumentar a frequência do número de vibrações por segundo torna o som mais agudo, enquanto a operação inversa produz um som mais grave.
Joseph Sauver, considerado o pai da acústica musical, descobriu o número exato de vibrações em cada som para o ouvido humano o captar. Estabeleceu-se entre 30.000 e 40.000 vibrações por segundo.
| Galileu Galilei |
 |
| Pitágoras |
sábado, 4 de maio de 2013
Temperatura e Calor
A temperatura está relacionada com a energia cinética média dos corpúsculos que constituem o corpo.
O Calor é uma medida da energia térmica transferida espontaneamente entre sistemas a temperaturas diferentes.
Transferência de calor entre dois corpos - Quando dois corpos, a temperaturas diferentes, são postos em contacto um com o outro, há transferência de energia térmica do corpo com temperatura mais elevada para o corpo com a temperatura mais baixa.
Equilíbrio Térmico - Esta transferência ocorre até que os dois corpos fiquem à mesma temperatura. Quando isto acontece, atinge-se o equilíbrio térmico e deixa de haver transferência de energia.
Energia Cinética
A Energia Cinética (Ec) é a energia associada ao movimento dos corpos.
Por exemplo, um automóvel ou as pessoas possuem energia cinética quando se movimentam. A energia térmica está associada à agitação das partículas, a energia eólica ou a energia hídrica estão associadas ao movimento do vento e da água, respetivamente.
A Energia Cinética depende da massa (m) do corpo e da velocidade (v) a que o corpo se desloca, podendo ser calculada utilizando a expressão:
Analisando atentamente a expressão, pode concluir-se que a energia cinética que um corpo possui é tanto maior quanto maior for a sua massa e a velocidade a que esse corpo se desloca.
Por exemplo, um automóvel ou as pessoas possuem energia cinética quando se movimentam. A energia térmica está associada à agitação das partículas, a energia eólica ou a energia hídrica estão associadas ao movimento do vento e da água, respetivamente.
A Energia Cinética depende da massa (m) do corpo e da velocidade (v) a que o corpo se desloca, podendo ser calculada utilizando a expressão:
Analisando atentamente a expressão, pode concluir-se que a energia cinética que um corpo possui é tanto maior quanto maior for a sua massa e a velocidade a que esse corpo se desloca.
segunda-feira, 18 de fevereiro de 2013
Energia Potencial
Energia Potencial (Ep) - energia que se encontra armazenada nos corpos e que pode vir a ser utilizada.
- Ep química - Ex: alimentos e pilhas;
- Ep elástica - Ex: elásticos e molas;
- Ep gravítica - Qualquer corpo possui Energia Potencial Gravítica
domingo, 17 de fevereiro de 2013
Energia
O Sol é a fonte primária de Energia. A energia solar é responsável por praticamente todos os processos naturais observáveis no planeta Terra. Da energia eólica associada a furacões à energia térmica no solo dos desertos ardentes, da energia cinética nas águas de um rio com grande caudal à energia potencial presente no vapor de água nas nuvens, da energia elétrica numa tempestade de raios à energia hidrelétrica, da energia fossil à renovável, da energia que as plantas usam para crescer até a que usamos para viver, todas têm por fonte primária a energia solar. São raros os processos na superfície da Terra que não se ligam de alguma forma à energia solar.
Manifestações de Energia
Como se pode detetar a Energia?
Manifestações de Energia
Como se pode detetar a Energia?
- energia luminosa (luz);
- energia sonora (som);
- energia térmica (aquecimento dos corpos);
- energia radiante (microondas;raioX; ultravioletas;infravermelhos...)
Catalisadores
Os catalisadores são substâncias que interferem na velocidade das Reações Químicas, sem serem consumidos durante o processo.

- Catalisadores Positivos ou Catalisadores - aceleram a reação química.
- Catalisadores negativos ou Inibidores - Retardam a reação Química ( diminuem a velocidade da reação química).

Os Fatores que influenciam a velocidade das Reações Químicas
A velocidade de uma reação química depende da natureza dos reagentes e das condições em que é realizada. Os fatores que influenciam a velocidade de uma reação química são:
- concentração dos reagentes;
- estado de divisão dos reagentes sólidos;
- temperatura do sistema reaccional;
- luz;
- presença de catalisadores.
Velocidade das Reações Químicas
- Durante uma reação química,os reagentes reagem entre si originando novas substâncias: os produtos de reação.
- As reações químicas não ocorrem todas à mesma velocidade, umas são rápidas e outras lentas. Há reações que são instantâneas e outras que demoram milhares de anos para ocorrer.
- A rapidez com que os reagentes se consomem e os produtos de reação se formam caracteriza a velocidade de uma reação química.
 |
| Explosão - Reação Rápida |
Iões
Os Iões são partículas com carga elétrica(positiva ou negativa), que derivam de um átomo ou de um conjunto de átomos.
Os iões com carga elétrica positiva são chamados de catiões e os iões com carga elétrica negativa são chamados de aniões.
Os iões resultam de átomos ou moléculas por perda ou ganho de eletrões.
A fórmula do ião deve indicar o átomo ou átomos que lhe deram origem, através dos respetivos símbolos, e a carga do ião.
Os iões com carga elétrica positiva são chamados de catiões e os iões com carga elétrica negativa são chamados de aniões.
Os iões resultam de átomos ou moléculas por perda ou ganho de eletrões.
A fórmula do ião deve indicar o átomo ou átomos que lhe deram origem, através dos respetivos símbolos, e a carga do ião.
Tabela de Iões
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Subscrever:
Mensagens (Atom)